高中化学摩尔质量的解题技巧(高中化学钠镁)

一、钠及其化合物
1、氧化钠和过氧化钠:Na2O和Na2O2的比较
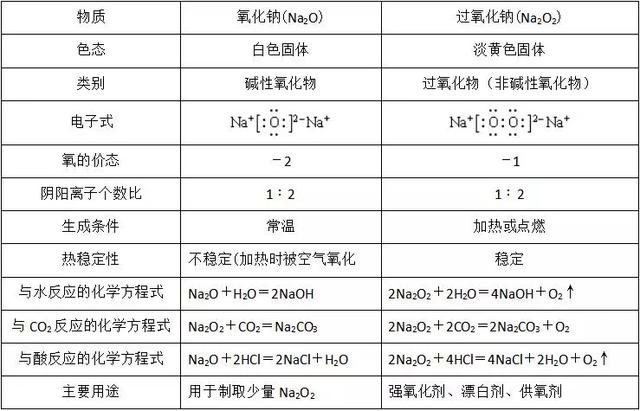
2、碳酸钠与碳酸氢钠


⑤Na2O2具有漂白性,投入品红溶液中,可使品红溶液褪色。


(1)热稳定性不同:

(2)和酸反应生成气体的速率不同(相同条件下)

(3)阴离子不同:
(4)溶液的酸碱性不同:

二、铝及其化合物


1、氧化铝和氢氧化铝

2.常见的铝盐:
(1)硫酸铝钾[KAl(SO4)2]是由两种不同的金属离子和一种酸根离子组成的复盐。
(2)明矾的化学式为:KAl(SO4)2·12H2O,它是无色晶体,可溶于水,水溶液pH<7。明矾可以净水,其净水的原因是:Al3++3H2O≒Al(OH)3(胶体)+3H+,Al(OH)3胶体且有较大表面积能吸附水中杂质形成沉淀而净水。
注意:
明矾的净水作用与液氯对自来水的消毒作用原理不同。明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,而液氯只能杀菌消毒,不能沉淀悬浮的杂质。
1、“铝三角”之间的转化
(1)“铝三角”之间的转化:

(2)有关Al(OH)3沉淀的计算:
①Al3++3OH-===Al(OH)3↓、②Al(OH)3+OH-=== AlO2-+2H2O
由①②得:③Al3++4OH-=== AlO2-+2H2O,则


3<

2、有关铝及其化合物的反应图像
(1)反映Al3+、Al(OH)3、AlO2-之间转化的有关图像:
a、把强碱溶液逐滴加入到铝盐(Al3+)溶液中至过量
①现象:先有白色沉淀产生,然后沉淀逐渐溶解。
②有关反应:A→B:Al3++3OH-===Al(OH)3↓、B→D:Al(OH)3+OH-=== AlO2-+2H2O
③图像:

b、把铝盐(Al3+)溶液逐滴加入到强碱溶液中至过量
①现象:先无明显现象,然后逐渐产生大量的白色沉淀。
②有关反应:A→B:Al3++4OH-=== AlO2-+2H2O、B→C:Al3++3 AlO2-+6H2O===4Al(OH)3↓
③图像:

c、在AlO2-溶液中逐滴加入强酸至过量
①现象:先生成白色沉淀,随后沉淀逐渐溶解。
②有关反应:A→B:AlO2-+H++2H2O===Al(OH)3↓、B→D:Al(OH)3+3H+===Al3++3H2O
③图像:

d、在强酸溶液中逐滴加入AlO2-溶液至过量:
①现象:先无明显现象,反应一段时间后逐渐产生白色沉淀。
②有关反应:A→B:4H++AlO2-===Al3++4H2O、B→C:Al3++3 AlO2-+6H2O===4Al(OH)3↓
③图像:

e、向含Mg2+和Al3+的酸性溶液中逐滴加入强碱溶液:
①现象:无明显现象→出现沉淀→渐多→最多→减少→不变
②反应:O→A:H++OH-===H2O、A→B:Al3++3OH-===Al(OH)3↓、Mg2++2OH-===Mg(OH)2↓、B→C:Al(OH)3+OH-=== AlO2-+2H2O。
③图像[c(Mg2+)=c(Al3+)]:

(2)反映Al3+、Al(OH)3、AlO2-之间转化的计算——数轴分析与图表法
①根据AlCl3与NaOH的量计算生成Al(OH)3的量:

②根据AlCl3与Al(OH)3的量计算需要NaOH的量

③根据NaAlO2与HCl计算生成Al(OH)3的量:

④根据Al(OH)3和NaAlO2的量计算需要加入的HCl的量

三、镁及其化合物
镁及其化合物的转化关系图:


免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。






